Partnerbeitrag: Bayer Vital GmbH
Ende Februar 2023 erhielt der selektive, nicht-steroidale, orale Androgenrezeptor-Inhibitor (ARI) Darolutamid in Kombination mit Docetaxel und Androgendeprivationstherapie (ADT) auf Basis von Daten aus der Zulassungsstudie ARASENS die Zulassungserweiterung für die Indikation des metastasierten hormonsensitiven Prostatakarzinoms (mHSPC). Dabei handelt es sich um den ersten und bislang einzigen ARI, der in dieser Kombination beim mHSPC zugelassen wurde. Darolutamid ist darüber hinaus bereits seit Mai 2020 dank starker Wirksamkeit und vorteilhafter Verträglichkeit bei Erhalt der Lebensqualität als geeignete Therapieoption für Männer mit nicht-metastasiertem kastrationsresistentem Prostatakarzinom und hohem Risiko für die Entwicklung von Metastasen (Hochrisiko-nmCRPC) verfügbar und als solche in aktuellen Leitlinien1,2 sowie in der Praxis etabliert.
ARASENS-Studie stößt Paradigmenwechsel in der Behandlung des mHSPC an
Der Therapiestandard des mHSPC hat sich im letzten Jahrzehnt von der chemischen Kastration durch Androgendeprivationstherapie (ADT) hin zur Kombination von Docetaxel, Abirateron oder Androgenrezeptorinhibitoren mit ADT entwickelt. Trotz dieser Fortschritte besteht nach wie vor ein ungedeckter medizinischer Bedarf in der Behandlung von mHSPC-Patienten, denen eine weitere Verbesserung des klinischen Nutzens zugutekommen würde. Der Schlüssel dafür könnte in einer frühen Behandlungsintensivierung durch die Kombination unterschiedlicher Wirkmechanismen liegen, die sowohl AR-abhängige als auch -unabhängige Signalwege beeinflussen. Aufgrund seines komplementären Wirkansatzes und seines geringen Potenzials für Wechselwirkungen und unerwünschte Ereignisse (UEs) ist Darolutamid daher eine logische Wahl als Kombinationspartner von Docetaxel. Prof. Dr. med. Peter Hammerer (Braunschweig) betont: „Beim Hochrisiko-nmCRPC hat sich Darolutamid bereits seit fast 3 Jahren als gut wirksame, lebensverlängernde und lebensqualitätserhaltende Therapie bewiesen. Dank der nun erfolgten Zulassungserweiterung von Darolutamid plus ADT in Kombination mit Docetaxel beim mHSPC können jetzt weitere Patienten – nämlich auch die im metastasierten hormonsensitiven Stadium – von einem längeren Leben bei günstigem Sicherheitsprofil unter Darolutamid profitieren.“

Darolutamid in Kombination mit Docetaxel zeigt Überlebensvorteil im Einklang mit Verträglichkeit beim mHSPC
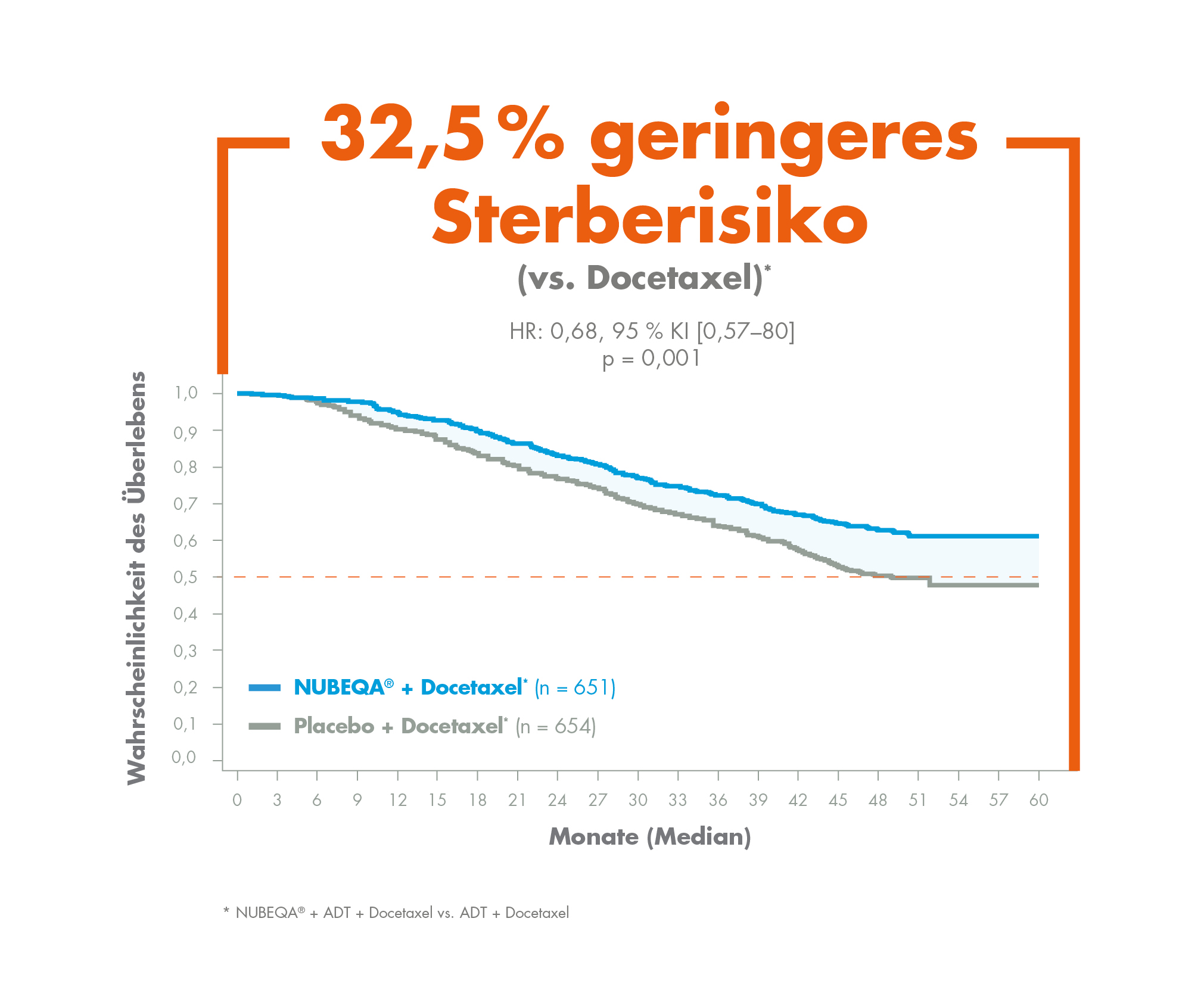
Bei der für die Zulassung von Darolutamid beim mHSPC zugrundeliegenden Studie ARASENS handelte es sich um eine globale, randomisierte, doppelblinde, Placebo-kontrollierte Phase-3-Studie. Insgesamt wurden 1.306 Patienten mit mHSPC eingeschlossen, die im Verhältnis 1:1 randomisiert wurden und entweder zweimal täglich 600 mg Darolutamid oder ein entsprechendes Placebo zusätzlich zu ADT und 6 Zyklen Docetaxel erhielten.3 Der primäre Endpunkt dieser Studie war das Gesamtüberleben, welches unter Darolutamid plus ADT und Docetaxel im Vergleich zu ADT plus Docetaxel mit einem um 32,5 % reduzierten Sterberisiko signifikant verlängert war.3 Der Vorteil bezüglich des Gesamtüberlebens war in allen vordefinierten Subgruppen konsistent und zeigte sich unabhängig vom Zeitpunkt der Metastasierung (de novo oder wiederkehrend), dem Ausmaß der Metastasierung (high oder low volume) und der Risikogruppe (high oder low risk) gleichermaßen.3,4 Auch klinisch relevante sekundäre Endpunkte wie Zeit bis zur Kastrationsresistenz, Zeit bis zur Schmerzprogression, Überleben ohne symptomatisches skelettales Ereignis und Zeit bis zum Beginn der anschließenden systemischen antineoplastischen Therapie verbesserten sich unter der Kombination signifikant.3 Speziell die Progression bis zur Kastrationsresistenz und der damit verbundenen schlechteren Prognose hinauszuzögern, ist für Patienten mit mHSPC von kritischer Bedeutung.7 Hierbei konnte Darolutamid plus ADT und Docetaxel das Risiko für das Auftreten einer Kastrationsresistenz im Vergleich zu ADT plus Docetaxel um 64 % reduzieren.3 In Bezug auf die Verträglichkeit waren die Inzidenzen UEs in beiden Behandlungsarmen insgesamt vergleichbar. Dabei gehörten viele der während der Behandlung am häufigsten auftretenden UEs zu den bekannten Nebenwirkungen von Docetaxel. Auch die Abbruchrate aufgrund von UEs war in beiden Behandlungsarmen ähnlich und lag unter Darolutamid plus ADT und Docetaxel bei 13,5 %, während sie unter ADT plus Docetaxel 10,6 % betrug.3 Prof. Dr. med. Martin Bögemann (Münster) fasste zusammen: „Die Daten aus ARASENS zeigen, dass die frühzeitige Behandlungsintensivierung mittels Kombination von Darolutamid und ADT zusammen mit einer Chemotherapie mit Docetaxel sinnvoll und wirksam ist. Dies eröffnet für eine Chemotherapie geeigneten Patienten neue Perspektiven in der Behandlung des mHSPC, insbesondere weil das Hinzufügen von Darolutamid den klinischen Nutzen deutlich verbessert, und dabei das Verträglichkeitsprofil der Therapie nicht in klinisch relevanter Weise verändert. Die gute Wirksamkeit und vorteilhafte Verträglichkeit von Darolutamid, die wir aus ARAMIS5,6 und dem klinischen Alltag vom Hochrisiko-nmCRPC kennen, bestätigen sich somit auch bei Patienten mit mHSPC.“
Frau Dr. Hellmis (Duisburg) spricht eine ausdrückliche Therapieempfehlung für die Kombination aus: „Patienten mit mHSPC, die sich ohnehin für eine Chemotherapie eignen, sollten meiner Meinung nach nun die Kombination von Darolutamid plus ADT und Docetaxel erhalten. Sie profitieren von einer signifikanten Wirksamkeit gegenüber ADT plus Docetaxel und erhalten mit Darolutamid langfristig eine Substanz mit vorteilhafter Verträglichkeit und der damit einhergehenden Lebensqualität.“
Wie ARASENS deutlich demonstriert, kann Darolutamid somit auch beim mHSPC mit starker Wirksamkeit und vorteilhafter Verträglichkeit überzeugen. Darolutamid besitzt daher großes Potenzial, sich zukünftig als bevorzugte Therapieoption in der Behandlung des mHSPC und des Hochrisiko-nmCRPC weiter zu etablieren.
Quellen
1 Leitlinienprogramm Onkologie, Version 6.2, Oktober 2021 S3-Leitlinie Prostatakarzinom. Online unter: https://www.leitlinienprogramm-onkologie.de/fileadmin/user_upload/Downloads/Leitlinien/Prostatatkarzinom/Version_6/LL_Prostatakarzinom_Langversion_6.2.pdf (letzter Zugriff: 23.02.2023).
2 Mottet N, et al. EAU – EANM – ESTRO – ESUR – ISUP – SIOG Guidelines on PROSTATE CANCER – LIMITED UPDATE MARCH 2022. Online unter: https://d56bochluxqnz.cloudfront.net/documents/full-guideline/EAU-EANM-ESTRO-ESUR-ISUP_SIOG-Guidelines-on-Prostate-Cancer-2022.pdf (letzter Zugriff: 23.02.2023)
3 Smith MR, et al. N Engl J Med. 2022; 386(12): 1132-1142.
4 Smith MR, et al. Presented at American Society of Clinical Oncology Genitourinary Cancers Symposium; San Francisco, CA. February 17-19, 2022; Abstract #13.
5 Fizazi K, et al. N Engl J Med. 2019;380(13): 1235-1246.
6 Fizazi K, et al. J Clin Oncol. 2020;38(suppl 15): 5514.
7 Cattrini C et al. Cancers (Basel). 2019;11(9):1355.